Habituellement, ce sont des pseudovirus dérivés du VIH qui sont produits. Pour rendre ce vecteur de transfert universel, le tropisme naturel du VIH, restreint par l’interaction entre la glycoprotéine d’enveloppe gp120 et le récepteur cellulaire CD4, a été modifié en remplaçant la glycoprotéine d’enveloppe du virus par la glycoprotéine du virus de la stomatite vésiculaire (VSV-g) permettant de donner ainsi aux virus un caractère pantropique (c’est-à-dire la capacité à infecter une très large population cellulaire comprenant toutes les cellules mammifères). Cette stratégie, est appelée pseudotypage.
Dans le cadre d’un projet sur le Sars-CoV-2 réalisé en collaboration avec l’équipe de Vincent Parissi MFP, UMRCNRS 5234), des lentiviraux pseudotypés avec la glycoprotéine d’enveloppe du SARS-CoV2 ont été produits et un modèle cellulaire exprimant le récepteur de l'enzyme de conversion de l’angiotensine 2 (ACE2) a été développé.
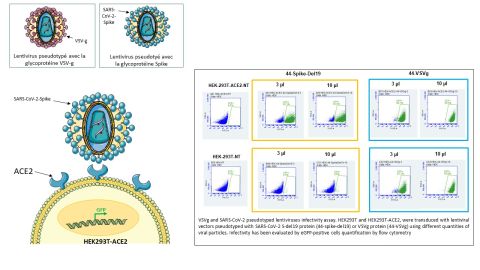
Dans le cas du Sars-CoV-2 qui est un virus enveloppé comme le lentivirus, c’est la protéine Spike (S) qui est responsable de l'attachement viral aux cellules hôtes, et qui entraine la fusion de l'enveloppe virale à la membrane de la cellule hôte conduisant à l'entrée du virus. Le Sars-CoV-2, responsable de la COVID-19, infecte les cellules via la liaison de sa protéine S au récepteur ACE2 présent notamment à la surface cellules épithéliales pulmonaires.
Pour comprendre le mécanisme d'entrée du virus, étudier l’évolution du tropisme en fonction des nouveaux variants, ou encore pour tester de nouvelles molécules inhibitrices, il est essentiel d'étudier comment la protéine S interagit avec le récepteur cellulaire. Cependant, ces études sont entravées par la difficulté de produire et de manipuler le Sars-CoV-2 sauvage qui nécessite des laboratoires de sécurité biologique de niveau 3 (L3).
Une alternative à l'utilisation d'un coronavirus sauvage consiste à utiliser un lentivirus recombinant pseudotypé avec la protéine du coronavirus S. Lors de l'empaquetage d'un lentivirus recombinant, la protéine S est introduite dans l'enveloppe virale. Le lentivirus pseudotypé résultant peut maintenant utiliser la protéine S exprimée à sa surface pour entrer dans les cellules hôtes possédant le récepteur approprié, mimant ainsi le mécanisme d'entrée du virus. Le lentivirus recombinant est très sûr et peut être pseudotypé avec des protéines S de type sauvage ou mutante.
Vect’UB propose une variété de vecteurs lentiviraux pseudotypés avec la protéine S, sauvage ou délétée (Del19) (mutants en prévision), exprimant des rapporteurs tels que l‘eGFP ou la luciférase, permettant le suivi de l'entrée du virus dans les cellules hôtes.
Une lignée cellulaire HEK-293T optimisée exprimant un niveau élevé du récepteur ACE2 humain permettant de modéliser l’entrée du virus a également été développée. Les résultats publiés dans la revue Viruses (Viruses 2021, 13, 365. https://doi.org/10.3390/v13030365) ont montré grâce à l’utilisation d’un rapporteur fluorescent, que les pseudotypes Sars-CoV-2 pouvaient transduire efficacement les cellules 293T exprimant le récepteur ACE2, contrairement aux cellules 293T dans lesquelles l'expression de ACE2 est absente.
Le pseudotypage des vecteurs lentiviraux ouvre également des perspectives très prometteuses pour le ciblage des cellules cancéreuses.