Les travaux, débutés avant la crise sanitaire, se sont retrouvés au cœur de l’actualité puisqu’ils s’intéressent aux adénovirus qui ont été largement utilisés dans le monde comme vecteur de vaccination lors de la pandémie de Covid.
Ces virus sont exceptionnellement efficients pour délivrer leur génome dans le noyau et réguler l’expression de leurs gènes. Le but de ce projet était de comprendre comment et pourquoi le génome de l’adénovirus s’exprime de façon aussi efficace après l’infection de la cellule.
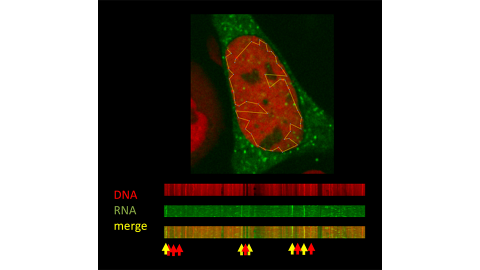
L’ADN de l’adénovirus est très condensé lorsqu’il est dans la particule virale et ce, grâce à son association avec la protéine virale VII. Et, une fois que le virus pénètre dans la cellule, il suffit d’environ 30 minutes pour que cet ADN « emballé » termine son voyage vers le noyau. Les scientifiques se sont intéressés au changement de structure et à l’expression du génome du virus au cours du temps, soit à 30 minutes, 1 heure, 2 heures et 4 heures après l’infection. Les auteurs ont ainsi combiné l'ARN-seq, la MNase-seq, la ChIP-seq et l'imagerie avec une collaboration avec le BIC pour mener à bien leurs travaux.
Ils ont montré que le génome du virus est importé très vite dans le noyau mais que son expression commence plus tardivement. Ils se sont alors demandés ce qu’il se passe pendant ces 4 premières heures, cruciales pour la réussite de l’infection par le virus.
Les scientifiques ont montré que l’ADN du virus ainsi libéré dans le noyau est décompacté pour pouvoir exprimer ses gènes. Au cours de ce processus, les protéines VII sont spécifiquement retirées et remplacées par des histones cellulaires H3.3 à des positions bien spécifiques de la région promotrice des premiers gènes exprimés. Ce changement permet ensuite la transcription du génome viral.
Harald Wodrich et son équipe, en collaboration avec l’équipe de Gernot Laengst ont également montré que le positionnement de la protéine VII sur le génome viral n’est pas dû au hasard mais qu’il dépend de séquences spécifiques de l’ADN viral.
En comprenant la dynamique complexe de la structure du génome adénoviral au cours des premières étapes de l’infection, l’objectif des chercheurs est d’exploiter ces connaissances pour améliorer encore la conception des vecteurs adénoviraux. Cela est prometteur pour les applications telles que la vaccination, la thérapie génique ou encore la conception de vecteurs oncolytiques.
Les équipes d’Harald Wodrich et Gernot Laengst de l’Université de Ratisbonne poursuivent leurs travaux notamment en se questionnant sur la machinerie cellulaire qui enlève cette protéine VII du génome viral.
L’ensemble de ces travaux a été financé par la Fondation pour la Recherche Médicale.