Les macrophages sont bien connus pour leur capacité à « manger » (phagocyter) et digérer les agents pathogènes, notamment les bactéries. Ce rôle a longtemps été perçu comme purement destructeur : neutraliser la menace et l’éliminer. Mais la réalité semble plus complexe. Cette étude montre que, dans un contexte infectieux où les bactéries prolifèrent et consomment les ressources disponibles, les macrophages s’adaptent : ils digèrent les bactéries et en recyclent les composants pour survivre et fonctionner. Une stratégie de défense métabolique inédite qui révèle toute la sophistication de ces cellules immunitaires.
Les macrophages, recycleurs de bactéries
Cette découverte s’inscrit dans le cadre de la thèse de Juliette Lesbats, dirigée par Johan Garaude. Tout est parti d’une interrogation simple : et si les macrophages tiraient un avantage métabolique de ce qu’ils digèrent ?
Les premières expériences mettent en évidence une modification de leur respiration mitochondriale en présence de bactéries, comparable à ce qui est observé avec des nutriments classiques. « Nous avons comparé leur activité métabolique en présence de bactéries ou de simples nutriments, et constaté des réponses similaires », précise Juliette Lesbats.
Pour aller plus loin, les scientifiques marquent des bactéries au carbone 13, permettant de suivre le devenir de leurs composants à l’intérieur des macrophages. Grâce à des analyses protéomiques (SILAC) et métabolomiques par spectrométrie de masse, ils démontrent que des fragments issus des bactéries digérées sont incorporés dans les protéines et les métabolites du macrophage. « L’un des points clés a été de montrer que dans les protéines, on peut séparer celles qui viennent de la bactérie de celles du macrophage », ajoute Juliette Lesbats. « Pour les métabolites, on a ciblé des molécules spécifiques du macrophage, comme l’itaconate, que les bactéries ne produisent pas. »
L’étude remet en question également un principe immunologique établi : la supposée étanchéité du phagosome. Cette vésicule intracellulaire, censée isoler complètement le pathogène, s’avère en réalité perméable à certains composants bactériens. « L’un des apports de notre travail a été de démontrer que le phagosome n’est pas totalement hermétique. Certains éléments peuvent en sortir et être utilisés par le macrophage », souligne Johan Garaude.
Cette perméabilité varie selon que la bactérie phagocytée est vivante ou morte. « Quand le macrophage ingère une bactérie vivante, le phagosome reste fermé. En revanche, avec une bactérie morte, il laisse passer davantage de choses », précise-t-il. Le macrophage ajuste ainsi sa stratégie selon la nature du danger.
La plasticité du phagosome a une importance particulière dans le contexte d’une infection. Les bactéries consomment les nutriments du tissu infecté pour se multiplier rapidement. Les macrophages doivent faire face à cette pénurie. « Nous avons montré que dans un environnement pauvre en nutriments, les macrophages survivent plus longtemps s’ils peuvent digérer des bactéries », indique Johan Garaude.
Ce recyclage modifie aussi leur façon de répondre à l’infection : « Les bactéries vivantes stimulent fortement la réponse immunitaire. En revanche, face à des bactéries mortes, les macrophages initient une réponse plus modérée, orientée vers la réparation tissulaire », ajoute-t-il.
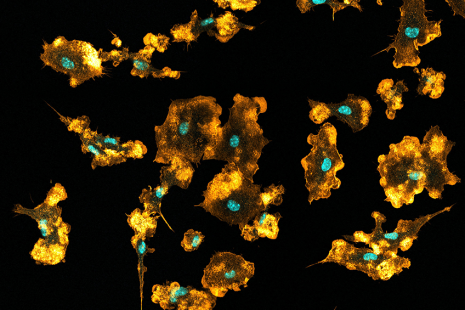
Macrophages de souris visualisés en imagerie par microscopie confocale. Les noyaux sont visibles en bleu, le réseau d'actine en orange. © Mónica Fernández Monreal, Bordeaux Imaging Centre
Une recherche inventive et collaborative
Au cours de cette étude, de nombreuses approches ont été détournées ou adaptées pour répondre à cette question originale. « Il a fallu inventer des protocoles, détourner les outils de leur usage classique », raconte Juliette Lesbats. Jean-William Dupuy, responsable des analyses protéomiques, ajoute : « Les logiciels d’analyse automatisée n’étaient pas adaptés à nos données. Nous avons validé manuellement chaque spectre, pour s’assurer que les peptides identifiés provenaient bien de protéines du macrophage ayant intégré des composants bactériens. »
Le projet s’est appuyé sur une collaboration étroite entre chercheurs de Bordeaux, Berlin, Denver et Madrid, sans financement dédié. « L’université de Denver nous a beaucoup aidés, en prenant en charge une grande partie des analyses métabolomiques. Cela aurait coûté des centaines de milliers d’euros », souligne Johan Garaude.
Parmi les résultats marquants figure aussi la découverte d’une molécule biologique - l’AMP cyclique (AMPc) - retrouvée en grande quantité dans les bactéries mortes. « Cette molécule ne s'accumule normalement pas chez les bactéries vivantes, ce qui pourrait expliquer pourquoi le macrophage ajuste sa réponse en fonction de l’état de sa cible », explique Benoît Pinson.
Vers de nouvelles stratégies vaccinales ?
Bien que cette recherche soit avant tout fondamentale, ses implications sont nombreuses. En vaccinologie, par exemple, elle ouvre des pistes pour concevoir des vaccins à base de bactéries mortes, mais perçues comme actives par le système immunitaire. « En manipulant la perception du macrophage, on pourrait renforcer l’efficacité des vaccins inactivés », propose Johan Garaude.
Le projet, mené sans financement propre dédié, a mobilisé une large équipe pluridisciplinaire et internationale. Parmi les contributeurs figurent Charlène Lhuissier, Aurélia Brillac, Jean-William Dupuy, Benoît Pinson, Angèle Sequeira, Gaia Tioli du Département SBM, ainsi que Julie A. Reisz, Parnika Mukherjee, Mónica Fernández-Monreal, Celia De La Calle Arregui, Daniel Wendisch, Benoît Rousseau, Alejo Efeyan, Leif Erik Sander, Angelo D’Alessandro, avec le soutien de partenaires de renom : la Charité de Berlin, l’Université du Colorado et le CNIO à Madrid.
À la croisée de la microbiologie, de l’immunologie et du métabolisme cellulaire, cette étude révèle à quel point les cellules immunitaires sont capables de finesse et d’adaptation.
Nature. 2025-02-25; :
DOI: 10.1038/s41586-025-08629-4
Interview réalisée par Hande Sena Kandemir, sous validation scientifique de Béatrice Turcq.
Crédits photo - Image généré par l'IA


